 |
|
Экспертный центр создан в 2022 г. по инициативе Директора ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России. Такой центр в области эндокринологии создан впервые в Российской Федерации. Исследовательская среда способствует развитию инноваций, междисциплинарного сотрудничества. Кадровый потенциал и принципы работы
|
|
НМИЦ эндокринологии, как ведущее в России медицинское учреждение по лечению и изучению эндокринных заболеваний, располагает уникальным научным потенциалом.
|
|
149
КАНДИДАТОВ
МЕДИЦИНСКИХ НАУК |
58
ДОКТОРОВ
МЕДИЦИНСКИХ НАУК |
4
ЧЛЕН-КОРРЕСПОНДЕНТА
РОССИЙСКОЙ АКАДЕМИИ НАУК |
5
АКАДЕМИКОВ
РОССИЙСКОЙ АКАДЕМИИ НАУК |
|
Целью создания центра стала оптимизация экспертно-научной деятельности ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России по профильным направлениям в области лекарственных и диагностических препаратов, медицинских изделий, обогащенных продуктов питания, пищевых добавок, биологически-активных добавок, программ разработки и изучения новых лекарств и диагностикумов, электронных персональных медицинских помощников, баз данных. Все наши лаборатории оснащены в соответствии с международными стандартами. Работа Экспертного центра базируется на принципах строгого соответствия этическим и правовым стандартам и высокого уровня профессионализма. В рамках работы Экспертного центра проводятся исследования эффективности и безопасности применения систем непрерывного мониторинга уровня глюкозы, индивидуальных носимых дозаторов (помпы), анализаторов определения гликированного гемоглобина с целью их регистрации и дальнейшего внедрения в клиническую практику в РФ для достижения удовлетворительного гликемического контроля у пациентов с сахарным диабетом. По результатам клинических испытаний наши Эксперты дают заключение о работе медицинских изделий, а при выявлении недостатков, дают рекомендации по их устранению и улучшению функциональности / безопасности и совместно с производителями ведут работу над их устранением.
Основные направления Экспертного центра:
Клинические исследования:
Испытания медицинских изделий:
Штат экспертного центра
Руководитель Экспертного центра: д.м.н. Гагик Радикович Галстян Заместитель руководителя Экспертного центра: к.м.н. Ирина Павловна Малая Начальник отдела клинических исследований: Екатерина Олеговна Кокшарова Врач-эндокринолог: Екатерина Евгеньевна Мишина Средний медицинский персонал. |
Миссия исследований
|
|
|
Клинические исследования — неотъемлемый этап разработки лекарственных препаратов и изучения их свойств в процессе применения у человека
|
|
|
Благодаря появлению новых лекарств человечество научилось бороться с заболеваниями, которые ранее считались неизлечимыми. Лекарственные препараты спасают жизни и облегчают проявления заболеваний. Ежегодно на рынок выводится множество лекарственных препаратов. Перед использованием нового препарата для лечения пациентов необходимо убедиться в следующем:
Для этого проводят несколько этапов клинических исследований, как правило, сначала у здоровых добровольцев, а затем у пациентов с соответствующим заболеванием. Путем применения научных методов получают информацию о безопасности, качестве и эффективности лекарственного препарата, а также о возможных нежелательных реакциях. На основании полученных данных можно сделать вывод об эффективности и безопасности лекарственного препарата, оптимальной дозировке, а также о показаниях и противопоказаниях к его применению. |
|
|
Участники клинических исследований получают доступ к самым новым лекарственным препаратам, которые, как ожидается, обладают высокой эффективностью и которые еще невозможно купить в аптеке. Чем больше исследований выполнено для нового препарата, тем больше доступно информации о его свойствах. Планируемые клинические исследования новых (еще не зарегистрированных) лекарственных препаратов проходят тщательную научную и этическую экспертизу и начинаются в клинике только после получения разрешения уполномоченного государственного органа России — Минздрава РФ. |
|
Какие исследования мы проводим
|
|
|
|
|
На сегодняшний день в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России выполнено более 200 клинических исследований различных лекарственных препаратов
Мы помогаем российским и зарубежным фармацевтическим компаниям всесторонне изучать современные лекарства и предоставляем возможность принять участие в клинических исследованиях:
Преимущества нашего центра |
||
|
Уникальная команда
профессионалов |
Наши специалисты
изучают редкие заболевания |
Быстрое оформление
договора |
 ПРИНЯТЬ УЧАСТИЕ В ИССЛЕДОВАНИЯХ
ПРИНЯТЬ УЧАСТИЕ В ИССЛЕДОВАНИЯХ
 |
|||
|
Если Вас заинтересовала информация о клинических исследованиях, и Вы хотите принять в них участие, Вы можете заполнить форму ниже, оставив информацию о себе и пожелание о выборе клинического исследования. Наши специалисты зарегистрируют Ваши данные и, когда у нас появится подходящее исследование, свяжутся с Вами. Чем более подробную информацию о себе и о Вашем заболевании Вы оставите, тем легче нашим специалистам будет подобрать исследование для Вас. Смотреть перечень исследований, разрешенных Минздравом России Исследования проводятся на безвозмездной основеЗаявка на участие в клиническом исследовании |
 СОГЛАСОВАНИЕ ДОГОВОРА
СОГЛАСОВАНИЕ ДОГОВОРА
 |
|
|
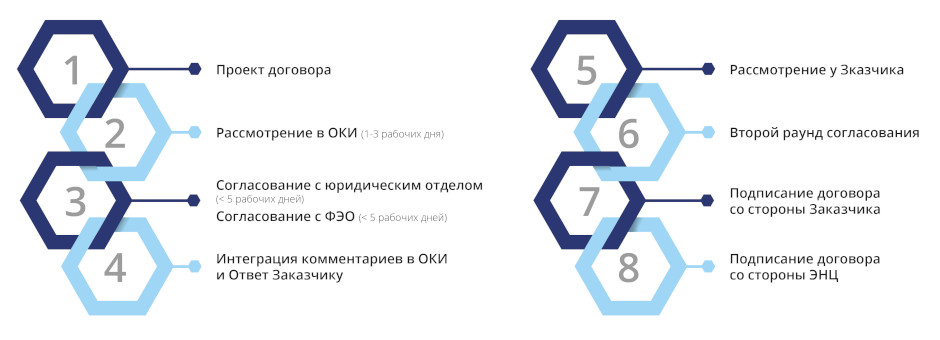
Пакет документов для согласования договора на проведение
клинических исследований Предварительное согласование договора проводится при предоставлении следующего комплекта документов:
Для подписания договора необходимо дополнительно предоставить:
По вопросам согласования договора:Ирина Павловна Малая — заместитель руководителя Экспертного центра ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России Адрес: 117292, г. Москва, ул. Дмитрия Ульянова, д. 11 м. Академическая Телефон: +7 499 124-34-22 доб. 6315 E-mail: malaya.irina [at] endocrincentr.ru
|
Контакты отдела клинических исследований
 |
||||
|
Связаться с отделом клинических исследований
|
||||
|
Кокшарова Екатерина Олеговна — начальник отдела клинических исследований ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России Адрес: 117292, г. Москва, ул. Дмитрия Ульянова, д. 11 м. Академическая Телефон: +7 499 124-34-22 доб. 6315 E-mail: koksharova.ekaterina [at] endocrincentr.ru |
||||
 |
|
|
На данный момент особое внимание уделяется роли эндокринной системы в организме и некоторых методов лечения хронических эндокринных заболеваний, таких как сахарный диабет. Тем не менее, существует значительная зависимость от хронического лечения многих эндокринных состояний, поэтому необходимы дополнительные исследования для разработки более эффективных методов лечения. Наряду с клиническими исследованиями так же важно для пациентов с эндокринной патологией наличие медицинских изделий, которые смогут повлиять на качество их жизни. Таким образом, отдел по работе с медицинскими изделиями выполняет важную роль улучшении качества жизни пациентов с эндокринной патологией. В рамках отдела по работе с медицинскими изделиями проводится разработка и написание программ и протоколов клинических испытаний, а также консультирование по программам разработки медицинских изделий, проведение клинических испытаний медицинских изделий с последующей статистической обработкой результатов клинических испытаний, написание актов по результатам клинических испытаний.
 ЗАЯВЛЕНИЕ О ПРОВЕДЕНИИ КЛИНИЧЕСКИХ ИСПЫТАНИЙ
ЗАЯВЛЕНИЕ О ПРОВЕДЕНИИ КЛИНИЧЕСКИХ ИСПЫТАНИЙ
подробнее
Шаблон заявления в формате word
К заявлению необходимо приложить следующие документы (при их наличии): – разрешение на проведение клинических испытаний, выданное Росздравнадзором; – техническую и эксплуатационную документацию производителя (изготовителя) на медицинское изделие; – сведения о нормативной документации на медицинское изделие; – цветные фотографические изображения общего вида медицинского изделия, его вариантов исполнения (моделей) и принадлежностей, необходимых для применения медицинского изделия по назначению (размером не менее 18 x 24 сантиметра), а также данные о маркировке и упаковке (цветные макеты упаковок и этикеток, содержащие текст маркировки на русском языке) (за исключением программного обеспечения, являющегося медицинским изделием, в том числе программного обеспечения с применением технологий искусственного интеллекта); – цветные фотографические изображения электронного носителя и интерфейса программного обеспечения (размером не менее 18 x 24 сантиметра) (для программного обеспечения, являющегося медицинским изделием, в том числе программного обеспечения с применением технологий искусственного интеллекта) (в случае, если имеется); – документы, подтверждающие результаты технических испытаний медицинского изделия; – документы, подтверждающие результаты токсикологических исследований; – результаты испытания в целях утверждения типа средств измерений (в отношении медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений, перечень которых утверждается Министерством здравоохранения Российской Федерации) – документы (материалы), содержащие данные о клиническом применении медицинского изделия, в том числе за пределами Российской Федерации, в том числе обзоры, отчеты о проведенных научных исследованиях, публикации, доклады, анализ риска применения, методы применения медицинского изделия (при наличии); – ссылку на ресурс в информационно-телекоммуникационной сети "Интернет", с которого может быть загружено программное обеспечение, являющееся медицинским изделием, в том числе программное обеспечение с применением технологий искусственного интеллекта (в случае отсутствия у программного обеспечения, являющегося медицинским изделием, в том числе программного обеспечения с применением технологий искусственного интеллекта, электронного носителя), а также перечень предоставленных производителем (изготовителем) медицинского изделия ключей, паролей доступа; – сведения о выданных регистрирующим органом разрешениях на ввоз медицинских изделий с целью их государственной регистрации, в том числе в целях внесения изменений в документы, содержащиеся в регистрационном досье на медицинское изделие – копия документа, подтверждающего полномочия уполномоченного представителя производителя (изготовителя).
В случае если оригиналы документов составлены на иностранном языке, они представляются с заверенным переводом на русский язык. Заявление необходимо представить на бланке организации и заверить подписью уполномоченного лица от имени Заявителя и печатью Контактная информацияИрина Павловна Малая — заместитель руководителя Экспертного центра ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России Адрес: 117292, г. Москва, ул. Дмитрия Ульянова, д. 11 м. Академическая Телефон: +7 499 124-34-22 доб. 6315 E-mail: malaya.irina [at] endocrincentr.ru |

